Sve tvari su građene od sitnih čestica koje nazivamo atomima.
Tvari građene od istih vrsta atoma su hemijski elementi, a tvari građene od različitih atoma su hemijska jedinjenja.
Atom je kuglasta čestica veoma malih dimenzija i mase, a predstavlja najmanju količinu nekog hemijskog elementa.
Poznato je 118 različitih atoma, koji međusobno grade ogroman broj hemijskih jedinjenja. Budući da postoji tako velik broj atoma, a samim tim i hemijskih elemenata, potrebno je obilježiti svaki atom da bi se omogućilo njihovo razlikovanje. Zbog toga su nastali hemijski simboli.
U početku su hemijski elementi prikazivani crtežima, da bi kasnije naučnik J.J.Bercelius predložio simbole sastavljene od prvog, odnosno prvog i slijedećeg karakterističnog slova iz latinskog naziva elementa.
Npr. Ugljik – lat. Carboneum – C
C označava pojam ugljika u kvalitativnom smislu i tačno JEDAN atom ugljika u kvantitativnom smislu. To vrijedi za simbole svih elemenata.
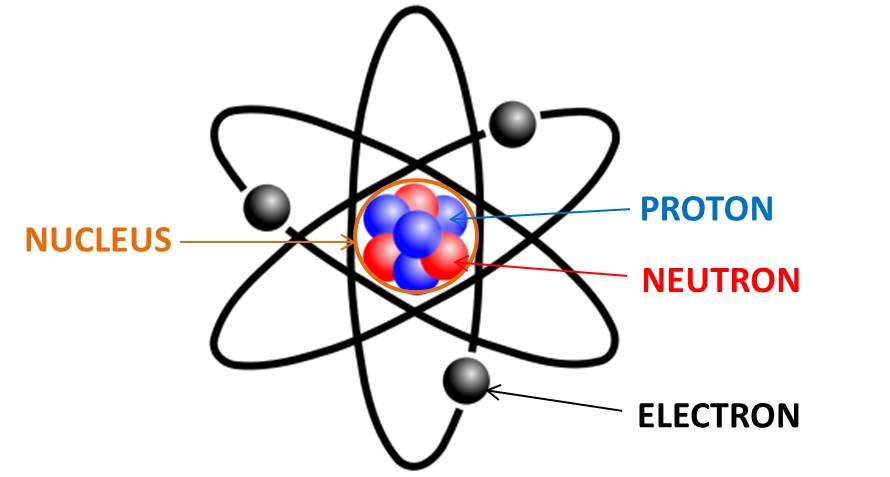
- Građa atoma-
Atom je građen od jezgra i omotača. U jezgru se nalaze protoni i neutroni, a u omotaču elektroni. Protoni i neutroni se jednim imenom nazvaju nukleoni.
• PROTONI su pozitivno naelektrisane čestice. (+)
• NEUTRONI su neutralne, nenaelektrisane čestice. (0)
• ELEKTRONI su negativno naelektrisane čestice. (-)
Atom kao cjelina je neutralna čestica jer sadrži jednak broj protona i elektrona. Kasnije ćemo naučiti šta se desi ako se promijeni ravnoteža između protona i elektrona i kako to utiče na atom.
Budući da su atomi sitne čestice, nevidljive golim okom, naučnici su se potrudili da nam predstave modele atoma, te olakšaju učenje i razumijevanje. Među najpoznatijima, našli su se Raderford i Bor, čiji se modeli i danas koriste, a prikazani su na slikama ispod.

Raderfordov model atoma Borov model atoma
Oba modela prikazuju jezgro na sredini atoma, oko kojeg se kreću elektroni po različitim nivoima.
Postoje određene veličine, jako bitne za razumijavanje građe atoma, a to su atomski i maseni broj.
- Atomski (redni) broj predstavlja broj protona u jezgru,a obilježava se sa Z. Piše se u donjem lijevom uglu simbola.
- Maseni broj predstavlja zbir protona i neutrona u jezgru, a obilježava se sa A. Piše se u gornjem lijevom uglu simbola.
- Primjer: Atom litija ima 3 protona u jezgru. Dakle njegov redni odnosno atomski broj je 3. Na osnovu toga, zaključujemo da je maseni broj litija 6, tj. zbir protona i neutrona.
Budući da se atomi istog elementa mogu razlikovati po broju neutrona u jezgru, a samim tim i po masenom broju, uvodi se novi pojam izotopi.
Dakle, izotopi su atomi jednog elementa istog atomskog, a različitog masenog broja, koji se razlikuju po broju neutrona u jezgru.
Primjer izotopa vodika sa nijednim, jednim i dva neutrona:

Osim po broju neutrona, atomi istih elemenata mogu se razlikovati po broju elektrona u omotaču. Tada govorimo o jonima. Već smo rekli da je atom neutralna čestica jer sadrži jednak broj protona i elektrona, odnosno jednak broj pozitivnog i negativnog naboja. Da to pobliže objasnimo, recimo da atom sadrži jednak broj „plusova“(+) i „minusa“(-).
Za elektrone smo rekli da se nalaze u elektronskom omotaču. Elektronski omotač sastoji se od jedne do sedam elektronskih ljuski.
Svaka ljuska predstavlja određeni nivo po kojem se kreću elektroni. Atomi imaju sposobnost da prime ili oslobode elektrone iz zadnje ljuske.
Atomi imaju sposobnost da prime ili oslobode elektrone iz zadnje ljuske.
Ako primi elektron u zadnju ljusku, atom prelazi u negativno stanje i postaje anion.
Ako oslobodi elektron iz zadnje ljuske, atom prelazi u pozitivno stanje i postaje kation.
Naboj jona piše se u gornjem desnom uglu simbola. Npr: H+ (predstavlja atom vodika koji je oslobodio jedan elektron, te postao pozitivno naelektrisani jon – kation).
U igrici možeš da sam izgradiš atom ili jon dodajući protone i neutrone u jezgro, te elektrone u omotač. Također možeš da vidiš ime atoma koji napraviš, njegov maseni broj, redni broj, te naboj.
